Les configurations électroniques sont essentielles pour comprendre comment les électrons sont disposés autour du noyau des atomes. Cette répartition influence les propriétés chimiques et physiques des éléments, ainsi que leur comportement dans diverses réactions. Cet article explore les principes de base des configurations électroniques, les règles qui les gouvernent, et leur importance dans la chimie et la physique modernes.
Principes Fondamentaux
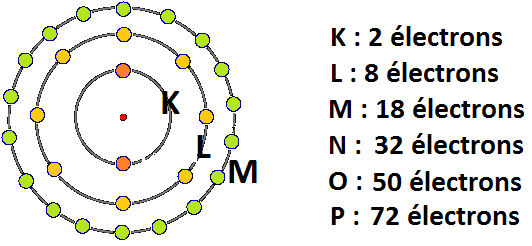
Les configurations électroniques décrivent la façon dont les électrons occupent les orbitales autour du noyau atomique. Les électrons se répartissent dans différents niveaux d’énergie et sous-niveaux (orbitales) selon des règles spécifiques. Ces règles sont cruciales pour déterminer la structure électronique d’un atome et prédire ses propriétés chimiques.
Règles de Construction
- Principe d’Aufbau : Ce principe stipule que les électrons remplissent les orbitales d’énergie la plus basse disponible avant de passer à des niveaux d’énergie plus élevés. Autrement dit, les électrons occupent d’abord les orbitales 1s, puis 2s, et ainsi de suite.
- Règle de Hund : Selon cette règle, les électrons occupent d’abord chaque orbitale d’un même sous-niveau de manière unitaire avant de doubler les électrons dans une orbitale donnée. Cela minimise la répulsion entre les électrons.
- Principe de Pauli : Le principe de Pauli énonce qu’aucun deux électrons dans un atome ne peuvent avoir les mêmes quatre nombres quantiques. En d’autres termes, deux électrons dans la même orbitale doivent avoir des spins opposés.
Notation des Configurations Électroniques
Les configurations électroniques sont souvent notées en utilisant une notation abrégée. Par exemple, l’atome de carbone (C) a une configuration électronique de 1s² 2s² 2p². Cette notation montre la distribution des électrons dans les différents niveaux et sous-niveaux.
- Notation de Shell : Les niveaux d’énergie sont notés par des chiffres (1, 2, 3, etc.), tandis que les sous-niveaux sont représentés par les lettres s, p, d, et f.
- Notation en Orbitales : Les orbitales sont représentées par des cases ou des diagrammes où les flèches indiquent les électrons.
Importance des Configurations Électroniques
La configuration électronique d’un atome détermine son réactivité chimique et ses propriétés physiques. Par exemple :
- Réactivité Chimique : Les éléments dans la même colonne du tableau périodique ont des configurations électroniques similaires, ce qui conduit à des propriétés chimiques similaires.
- Structure du Tableau Périodique : Les configurations électroniques permettent de comprendre la disposition des éléments dans le tableau périodique et les tendances périodiques telles que l’électronégativité et l’énergie d’ionisation.
- Liaison Chimique : La configuration des électrons influence la manière dont les atomes se lient pour former des molécules. Les électrons de valence jouent un rôle clé dans la formation de liaisons chimiques.
Conclusion
Les configurations électroniques sont fondamentales pour la chimie et la physique, offrant des informations essentielles sur la répartition des électrons autour du noyau atomique. Comprendre ces configurations aide à expliquer les propriétés des éléments, leur réactivité chimique et leur comportement dans divers contextes. En maîtrisant les principes de la distribution électronique, on peut mieux apprécier les interactions atomiques et les processus chimiques qui façonnent notre monde.